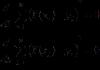Ионная связь объясняется следующим образом: атом - типичный металл - теряет свой валентный электрон, превращаясь в катион. Атом – типичный неметалл - принимает электрон, превращаясь в анион.
Na 0 – = Na + (катион)
Cl 0 + = Cl - - (анион)
Ионная связь является максимально полярной. Она образуется атомами тех элементов, которые имеют максимально различные электроотрицательности, т. е. ионная связь образуется щелочными и щелочно-земельными металлами и галогенами:KF; CaCl 2 ; NaI. Ионная связь имеет два основных свойства:
· ненаправленность,
· ненасыщаемость.
Эти два свойства тесно связанны между собой. Два иона: катион и анион полностью не могут компенсировать силовые поля друг друга, поэтому для компенсации своих зарядов каждый ион вынуждает притягивать из пространства дополнительные ионы противоположного знака. В этом заключается ненасыщаемость. Так как электрическое поле иона имеет сферический характер, то для ионной связи характерна ненаправленность. Благодаря тому, что энергия ионизации больше энергии сродства к электрону, полного перехода электронов не происходит даже в случае атомов с очень большой разностью электроотрицательности. Таким образом, соединений с чисто ионной связью не существует. Можно говорить лишь о доле ионной связи. В силу особенностей ионной связи, т.е. её полярности, ненаправленности и ненасыщаемости, молекулы с ионной связью являются достаточно относительным понятием. В водных растворах и расплавах ионные молекулы полностью диссоциированы на ионы: AB=A + +B - . Двух- и трёхионных соединений не существует, а весь кристалл ионного соединения можно рассматривать как молекулу, состоящую из огромного числа ионов:А m B n .
Ионная связь
Чисто ионной связью называется химически связанное состояние атомов, при котором устойчивое электронное окружение достигается путем полного перехода общей электронной плотности к атому более электроотрицательного элемента.
На практике полный переход электрона от одного атома к другому атому - партнеру по связи не реализуется, поскольку каждый элемент имеет большую или меньшую электроотрицательность, и любая химическая связь будет в некоторой степени ковалентной. Если степень ковалентной связи достаточна высока, то такая химическая связь является полярной ковалентной связью с той или иной степенью ионности. Если же степень ковалентности связей мала, по сравнению со степенью ее ионности, то такая связь считается ионной.
Ионная связь возможна только между атомами электроположительных и электроотрицательных элементов, находящимися в состоянии разноименно заряженных ионов. Процесс образования ионной связи позволяет объяснить электростатическая модель, т.е. рассмотрение химического взаимодействия между отрицательно и положительно заряженными ионами.
Ионы - это электрически заряженные частицы, образующиеся из нейтральных атомов или молекул путем отдачи или приема электронов.
При отдаче или приеме электронов молекулами образуются молекулярные или многоатомные ионы, например, - атион диоксигена, - нитрит-ион.
Одноатомные положительные ионы, или одноатомные отрицательные ионы, или одноатомные анионы, возникают при химической реакции между нейтральными атомами путем взаимопередачи электронов при этом атом, электроположительного элемента, обладающий небольшим числом внешних электронов, переходит в более устойчивое состояние одноатомного катиона путем уменьшения числа этих электронов. Наоборот, атом электроотрицательного элемента, имеющий большое число внешних электронов, переходит в более устойчивое для него состояние одноатомного иона путем увеличения числа электронов. Одноатомные катионы образуются, как правило, металлами, а одноатомные анионы - неметаллами.
При передачи электронов атомы металлических и неметаллических элементов стремятся сформироваться вокруг своих ядер устойчивую конфигурацию электронной оболочки. Атом неметаллического элемента создает вокруг своего остова внешнюю оболочку последующего благородного газа. Тогда как атом металлического элемента после отдачи внешних электронов получает устойчивую октетную конфигурацию предыдущего благородного газа.
Ионные кристаллы
При взаимодействии металлических и неметаллических простых веществ, сопровождающемся отдачей и приемом электронов, образуются соли. Пример:
2Na + Cl2 = 2NaCl ,
2Al + 3F2 = 2AlF3
Ионная связь характерна не только для солей производного бескислородных и кислородосодержащих кислот [типа NaCl, AlF3, NaNO3, Al(SO4)3], но и для других классов неорганических веществ - основных оксидов и гидроксидов [типа Na2O и NaOH], бинарных соединений [типа Li3N и CaC2]. Между ионами с противоположными по знаку зарядами проявляются электростатические силы притяжения. Такие силы притяжения изотропны, т.е. действуют одинаково, во всех направлениях. В результате расположение ионов в твердых солях упорядочивается в пространстве определенным образом. Система упорядочено расположенных катионов и анионов называется ионной кристаллической решеткой, а сами твердые вещества (соли, основные оксиды и гидроксиды) - ионными кристаллами.
Все ионные кристаллы имеют солеобразный характер. Под солеобразным характером понимается определенный набор свойств, отличающий ионные кристаллы от кристаллических веществ с другими типами решеток. Конечно, не все ионные решетки характеризуются таким расположением ионов в пространстве, число ионов - соседей с противоположным зарядом может быть и иным, однако чередование катионов и анионов в пространстве является обязательным для кристаллов.
Вследствие того, что кулоновские силы притяжения распространяются одинаково по всем направлениям, ионы в узлах кристаллической решетки связаны относительно прочно, хотя каждый из ионов не зафиксирован неподвижно, а непрерывно совершает тепловые колебания вокруг своего положения в решетке. Поступательное же движение ионов вдоль решетки отсутствует, поэтому все вещества с ионными связями при комнатной температуре - твердые (кристаллические). Амплитуда тепловых колебаний может быть увеличена нагреванием ионного кристалла, которое приводит в итоге к разрушению решетки и переходу твердого вещества в жидкое состояние (при температуре плавления). Температура плавления ионных кристаллов относительно высока, а температура кипения, при которой совершается переход жидкого вещества в самое неупорядоченное, газовое состояние, имеет очень большие значения. Пример:
Многие соли, особенно многоэлементные комплексные, а так же соли органических кислот могут разлагаться при температуре более низких, чем температура кипения и даже температура плавления.
Типичным свойством многих соединений с ионной связью (которые не взаимодействуют с водой или не разлагаются до плавления) является их способность к диссоциации на составляющие ионы; вследствие подвижности ионов водные растворы или расплавы ионных кристаллов проводят электрический ток.
В ионных кристаллах отсутствуют связи между отдельными парами ионов; точнее следует сказать, что все содержащиеся в образце ионного соединения катионы и анионы оказываются связанными.
В ионных кристаллах, построенных из катионов и анионов, молекулы отсутствуют.
Химические формулы ионных веществ передают только соотношение катионов и анионов в кристаллической решетке; в целом образец ионного вещества электронейтрален. Например, в соответствии с формулой ионного кристалла Al2O3 соотношение катионов Al3+ и анионов О2- в решетке равно 2:3; вещество электронейтрально - шесть положительных зарядов (2 Al3+) нейтрализуется шестью отрицательными зарядами (3 О2-).
Хотя реальных молекул в ионных кристаллах не существует для единообразия с ковалентными веществами принято с помощью формул типа NaCl и Al2O3 передавать состав условных молекул, следовательно, характеризовать ионные вещества определенными значениями относительной молекулярной массы. Это тем более оправдано, поскольку переход от ковалентной связи к ионной происходит постепенно и имеют лишь условную границу с х = 1,7.
Относительная молекулярная масса веществ с ионной связью находится сложением относительных атомных масс соответствующих элементов с учетом числа атомов каждого элемента.
Пример: Относительная молекулярная масса Al2O3 составляет:
Строение и форма кристаллов являются предметом исследования кристаллографии, а связь свойств кристаллов и их строения изучает кристаллохимия.
Следует отметить, что соединений в которых существует только ионная связь практически нет. Всегда между соседними атомами в кристалле возникают и ковалентные связи.
Природа металлической связи. Строение кристаллов металлов.
1. с. 71–73; 2. с. 143–147; 4. с. 90–93;8. с. 138–144; 3. с. 130–132.
Ионной химической связью называется связь, которая образуется между катионами и анионами в результате их электростатического взаимодействия. Ионную связь можно рассматривать как предельный случай ковалентной полярной связи, образованной атомами с сильно различающимися значениями электроотрицательности.
При образовании ионной связи происходит значительное смещение общей пары электронов к более электроотрицательному атому, который таким образом приобретает отрицательный заряд и превращается в анион. Другой атом, лишившись своего электрона, образует катион. Ионная связь образуется только между атомными частицами таких элементов, которые сильно отличаются по своей электроотрицательности (Δχ ≥ 1,9).
Ионная связь характеризуется ненаправленностью в пространстве и ненасыщаемостью . Электрические заряды ионов обусловливают их притяжение и отталкивание и определяют стехиометрический состав соединения.
В целом ионное соединение представляет собой гигантскую ассоциацию ионов с противоположными зарядами. Поэтому химические формулы ионных соединений отражают лишь простейшее соотношение между числами атомных частиц, образующих такие ассоциации.
Металлическая связь – в заимодействие, удерживающее атомные частицы металлов в кристаллах.
Природа металлической связи подобна ковалентной связи: оба типа связи основаны на обобществлении валентных электронов. Однако в случае ковалентной связи обобщаются валентные электроны только двух соседних атомов, в то время как при образовании металлической связи в обобществлении этих электронов принимают участие сразу все атомы. Невысокие энергии ионизации металлов обусловливают легкость отрыва валентных электронов от атомов и перемещение по всему объему кристалла. Благодаря свободному перемещению электронов металлы обладают высокой электрической проводимостью и теплопроводностью.
Таким образом, относительно небольшое количество электронов обеспечивает связывание всех атомов в кристалле металла. Связь такого типа, в отличие от ковалентной, является нелокализованной и ненаправленной .
7. Межмолекулярное взаимодействие . Ориентационное, индукционное и дисперсионное взаимодействие молекул. Зависимость энергии межмолекулярного взаимодействия от величины дипольного момента, поляризуемости и размера молекул. Энергия межмолекулярного взаимодействия и агрегатное состояние веществ. Характер изменения температур кипения и плавления простых веществ и молекулярных соединений р-элементов IV-VII групп.
1. с. 73–75; 2. с. 149–151; 4. с. 93–95; 8. с. 144–146; 11. с. 139–140.
Хотя молекулы в целом электронейтральны, между ними осуществляется межмолекулярное взаимодействие.
Силы сцепления, действующие между одиночными молекулами и приводящие вначале к образованию молекулярной жидкости, а затем молекулярных кристаллов, получили название межмолекулярных сил , или сил Ван-дер-Ваальса .
Межмолекулярное взаимодействие, как и химическая связь, имеет электростатическую природу , но, в отличие от последней, является очень слабым; проявляется на значительно больших расстояниях и характеризуется отсутствием насыщаемости.
Различают три типа межмолекулярного взаимодействия. К первому типу относится ориентационное взаимодействие полярных молекул. При сближении полярные молекулы ориентируются друг относительно друга в соответствии с знаками зарядов на концах диполей. Чем более полярны молекулы, тем прочнее ориентационное взаимодействие. Его энергия определяется, прежде всего, величиной электрических моментов диполей молекул (т. е. их полярностью).
Индукционное взаимодействие – это электростатическое взаимодействие между полярными и неполярными молекулами .
В неполярной молекуле под воздействием электрического поля полярной молекулы возникает «наведенный» (индуцированный) диполь, который притягивается к постоянному диполю полярной молекулы. Энергия индукционного взаимодействия определяется электрическим моментом диполя полярной молекулы и поляризуемостью неполярной молекулы.
Дисперсионное взаимодействие возникает в результате взаимного притяжения так называемых мгновенных диполей . Диполи такого типа возникают в неполярных молекулах в любой момент времени вследствие несовпадения электрических центров тяжести электронного облака и ядер, вызванного их независимыми колебаниями.
Относительная величина вклада отдельных составляющих в общую энергию межмолекулярного взаимодействия зависит от двух основных электростатических характеристик молекулы – ее полярности и поляризуемости, которые, в свою очередь, определяются размерами и структурой молекулы.
8. Водородная связь . Механизм образования и природа водородной связи. Сравнение энергии водородной связи с энергией химической связи и энергией межмолекулярного взаимодействия. Межмолекулярные и внутримолекулярные водородные связи. Характер изменения температур плавления и кипения гидридов р-элементов IV-VII групп. Значение водородных связей для природных объектов. Аномальные свойства воды.
1. с. 75–77; 2. с. 147–149; 4. с. 95–96; 11. с. 140–143.
Одной из разновидностей межмолекулярного взаимодействия является водородная связь . Она осуществляется между положительно поляризованным атомом водорода одной молекулы и отрицательно поляризованным атомом Х другой молекулы:
Х δ- ─Н δ+ Х δ- ─Н δ+ ,
где Х – атом одного из наиболее электроотрицательных элементов – F, O или N, а символ – условное обозначение водородной связи.
Образование водородной связи обусловлено, прежде всего, тем, что у атома водорода имеется только один электрон, который при образовании полярной ковалентной связи с атомом Х смещается в его сторону. На атоме водорода возникает высокий положительный заряд, что в сочетании с отсутствием внутренних электронных слоев в атоме водорода позволяет другому атому сближаться с ним до расстояний, близких к длинам ковалентных связей.
Таким образом, водородная связь образуется в результате взаимодействия диполей. Однако в отличие от обычного диполь-дипольного взаимодействия, механизм возникновения водородной связи обусловлен и донорно-акцепторным взаимодействием, где донором электронной пары является атом Х одной молекулы, а акцептором – атом водорода другой.
Водородная связь обладает свойствами направленности и насыщаемости. Наличие водородной связи существенно влияет на физические свойства веществ. Например, температуры плавления и кипения HF, H 2 O и NH 3 выше, чем у гидридов других элементов тех же групп. Причиной аномального поведения является наличие водородных связей, на разрыв которых требуется дополнительная энергия.
Ионная связь – возникает между разноимённо заряженными частицами – ионами в результате действия электростатических сил притяжения.
Механизм образования ионной связи можно рассмотреть на примере реакции между натрием и хлором. Атом щелочного металла легко теряет электрон, а атом галогена - приобретает. В результате этого возникает катион натрия и хлорид-ион. Они образуют соединение за счет электростатического притяжения между ними.
Взаимодействие между катионами и анионами не зависит от направления, поэтому о ионной связи говорят как о ненаправленной. Каждый катион может притягивать любое число анионов, и наоборот. Вот почему ионная связь является ненасыщенной. Число взаимодействий между ионами в твердом состоянии ограничивается лишь размерами кристалла. Поэтому "молекулой" ионного соединения следует считать весь кристалл.
Для возникновения ионной связи необходимо, чтобы сумма значений энергии ионизации Ei (для образования катиона) и сродства к электрону Ae (для образования аниона) должна быть энергетически выгодной. Это ограничивает образование ионной связи атомами активных металлов (элементы IA- и IIA-групп, некоторые элементы IIIA-группы и некоторые переходные элементы) и активных неметаллов (галогены, халькогены, азот).
Идеальной ионной связи практически не существует. Даже в тех соединениях, которые обычно относят к ионным, не происходит полного перехода электронов от одного атома к другому; электроны частично остаются в общем пользовании. Так, связь во фториде лития на 80% ионная, а на 20% - ковалентная. Поэтому правильнее говорить о степени ионности (полярности) ковалентной химической связи. Считают, что при разности электроотрицательностей элементов 2,1 связь является на 50% ионной. При большей разности соединение можно считать ионным.
Ионной моделью химической связи широко пользуются для описания свойств многих веществ, в первую очередь, соединений щелочных и щелочноземельных металлов с неметаллами. Это обусловлено простотой описания таких соединений: считают, что они построены из несжимаемых заряженных сфер, отвечающих катионам и анионам. При этом ионы стремятся расположиться таким образом, чтобы силы притяжения между ними были максимальными, а силы отталкивания - минимальными.
Ионная химическая связь – это связь, которая образуется между атомами химических элементов (положительно или отрицательно заряженные ионы). Так что же такое ионная связь, и как происходит ее образование?
Общая характеристика ионной химической связи
Ионы – это частицы, имеющие заряд, в которые превращаются атомы в процессе отдачи или принятия электронов. Притягиваются они друг к другу довольно сильно, именно по этой причине у веществ с таким типом связи высокие температуры кипения и плавления.

Рис. 1. Ионы.
Ионная связь – химическая связь между разноименными ионами, обусловленная их электростатическим притяжением. Ее можно считать предельным случаем ковалентной связи, когда разность электроотрицательностей связанных атомов так велика, что происходит полное разделение зарядов.

Рис. 2. Ионная химическая связь.
Обычно считается, что связь приобретает электронный характер, если ЭО >1,7.
Различие в значении электроотрицательности тем больше, чем дальше элементы расположены друг от друга в периодической системе по периоду. Эта связь характерна для металлов и неметаллов, особенно расположенных в наиболее удаленных группах, например, I и VII.
Пример: поваренная соль, хлорид натрия NaCl:

Рис. 3. Схема ионной химической связи хлорида натрия.
Ионная связь существует в кристаллах, она обладает прочностью, длиной, но не насыщена и не направлена. Ионная связь характерна только для сложных веществ, таких как соли, щелочи, некоторые оксиды металлов. В газообразном состоянии такие вещества существуют в виде ионных молекул.
Ионная химическая связь образуется между типичными металлами и неметаллами. Электроны в обязательном порядке от металла переходят к неметаллу, образуя ионы. В результате образуется электростатическое притяжение, которое называют ионной связью.
На самом деле полностью ионной связи не встречается. Так называемая ионная связь носит частично ионный, частично ковалентный характер. Однако связь сложных молекулярных ионов может считаться ионной.
Примеры образования ионной связи
Можно привести несколько примеров образования ионной связи:
- взаимодействие кальция и фтора
Ca 0 (атом) -2e=Ca 2 + (ион)
– кальцию легче отдать два электрона, чем получить недостающие.
F 0 (атом)+1е= F- (ион)
– фтору, наоборот, легче принять один электрон, чем отдать семь электронов.
Найдём наименьшее общее кратное между зарядами образующихся ионов. Оно равно 2. Определим число атомов фтора, которые примут два электрона от атома кальция: 2: 1 = 2. 4.
Составим формулу ионной химической связи:
Ca 0 +2F 0 →Ca 2 +F−2.
- взаимодействие натрия и кислорода