Оксиды неметаллов В оксидах неметаллов связь между атомами ковалентная полярная. Среди оксидов молекулярного строения есть газообразные - СO2, СО, N2O, NO, NO2, Сl2O, СIO2 и др.; жидкие (летучие) SO3, N2O3, Сl2O6, Сl2O7; твердые (летучие) - Р2O5, N2O5, SeO2; твердый, очень тугоплавкий нелетучий оксид SiO2 - вещество с атомной кристаллической решеткой. Оксиды неметаллов, как вы знаете, делят на два подкласса: несолеобразующие и солеобразующие. К несолсобразующим оксидам относят 8Ю, 1М20, N0, СО. Все остальные оксиды неметаллов являются солеобразующими, кислотными. Оксиды серы. Сера образует два оксида - SO2 и SO3. Оба оксида являются кислотными, т.е. взаимодействуют со щелочами, основными оксидами и водой. (Напишите уравнения соответствующих реакций.) При горении серы, полном сгорании сероводорода и обжиге сульфидов образуется оксид серы(IV), который часто называют сернистым газом. (Напишите уравнения соответствующих реакций.) Он хорошо растворяется в воде, образуя слабую сернистую кислоту. Она неустойчива и разлагается на исходные вещества: Н2O + SO2 ⇄ Н2SO3 При взаимодействии со щелочами сернистый газ образует два ряда солей - средние, или сульфиты, и кислые - гидросульфиты. (Почему!) Гидросульфит натрия NaHSO3 и сульфит натрия Na2SO3, как и сам сернистый газ, используют для отбеливания шерсти, шелка, бумаги и соломы, а также в качестве консервирующих средств для сохранения свежих плодов и фруктов. Оксиды азота. Азот образует немало оксидов, из которых наиболее известны оксиды со всем спектром степеней окисления азота от +1 до +5: N2O, NO, N2O3, NO2 (или N2O4) и N2O5. Оксиды азота(I), (II) N2O и NO - несолеобразующие оксиды; остальные - солеобразующие кислотные оксиды. Оксид азота(II) NO токсичен. Представляет собой бесцветный газ, без запаха, почти не растворим в воде. Оксид азота(II) легко окисляется кислородом воздуха в оксид азота(IV): 2NO + O2 = 2NO2 Оксид азота(IV) NO2 -- весьма токсичный бурый газ. Если растворять NO2 в воде в присутствии кислорода, то образуется азотная кислота: 4NO2 + O2 + 2Н2O = 4НNO3 Аналогично оксид NO2 реагирует с растворами щелочей: 4NO2 + 2Са(ОН)2 = Са(NO3)2 + Са(NO2)2 + 2Н2O Оксид азота(V) N2O5 - бесцветные кристаллы при температуре ниже 33,3 °С. Это типичный кислотный оксид, которому соответствует азотная кислота. Взаимодействует с водой, щелочами, оксидами металлов. (Напишите уравнения соответствующих реакций.) Оксид фосфора(V). Оксид фосфора(V), или фосфорный ангидрид, образуется при горении фосфора в виде густого белого дыма, состоящего из мелких белых кристалликов: 4Р + 5O2 = 2Р2O5 Это типичный кислотный оксид, который взаимодействует с водой, образуя фосфорную кислоту, а также с основными оксидами и щелочами с образованием различных солей: средних, или фосфатов, и кислых - гидрофосфатов и дигидрофосфатов: Р2O5 + 6NaOН = 2Na3РO4 + 3Н2O Р2O5 + 4NаОН = 2Na2НРO4 + Н2O Р2O5 + 2NaОН + Н2O = 2NaН2РO4 Оксиды углерода. Углерод образует два оксида: оксид угле-рода(II) СО и оксид углерода(IV) С02. Оксид углерода(II) имеет ряд синонимов: угарный газ, окись углерода, монооксид углерода. Это газ без цвета, запаха и вкуса; плохо растворим в воде. Как следует из тривиального названия, угарный газ очень ядовит, так как соединяется с гемоглобином крови и лишает его способности переносить кислород. Первая помощь при угаре - это свежий воздух. Оксид углерода(II) является сильным восстановителем, поэтому горит: 2СО + O2 = 2СO2 Он также восстанавливает металлы из их оксидов и потому применяется в пирометаллургии. Основой доменного процесса являются реакции, суммарное уравнение которых имеет вид: Fе2O3 + 3СО = 2Fе + 3СO2 Оксид углерода(IV) имеет много синонимических названий: углекислый газ, угольный ангидрид, диоксид углерода и даже химически неверное название «углекислота». В промышленности СO2 получают обжигом известняка, горением кокса или углеводородного сырья. В лаборатории углекислый газ получают действием соляной кислоты на мрамор (рис. 7.5): СаСО3 + 2НСl = СаСl2 + Н2O + СO2 Рис. 7.5. Получение углекислого газа в лабораторных условиях Молекула углекислого газа образована двумя двойными полярными ковалентными связями: О=С=О Из-за линейного строения несмотря на полярность связей молекула в целом неполярная, поэтому углекислый газ малорастворим в воде (0,88 объема СO2 в 1 объеме воды при температуре 20 °С). При охлаждении под давлением углекислый газ превращается в сухой лед - твердую снегообразную массу, которую в промышленности прессуют и используют для охлаждения продуктов, прежде всего мороженою. Углекислый газ при обычных условиях не имеет цвета, запаха и примерно в 1,5 раза тяжелее воздуха. По свойствам это типичный кислотный оксид, поэтому взаимодействует со щелочами, основными оксидами и водой: СO2 + ВаО = ВаСO3 СO2 + Са(ОН)2 = СаСO3 + Н2O Последняя реакция является качественной реакцией на углекислый газ, так как сопровождается помутнением известковой воды (цв. вклейка, рис. 27), которое, однако, исчезает при дальнейшем пропускании углекислого газа из-за превращения нерастворимого карбоната кальция в растворимый гидрокарбонат: СаС03 + С02 + Н20 = Са(НСО,)2 Рис. 27. Качественная реакция на углекислый газ: а – до пропускания; б – после пропускания CO2 Углекислый газ применяют в производстве сахара (для очистки сока свеклы), соды, мочевины, для приготовления газированных напитков, при тушении пожаров (рис. 7.6), в газовых лазерах. Твердый СО, - хладагент. Рис. 7.6. Для тушения пожаров используют углекислотный огнетушитель Оксид кремния(IV). Многие минералы образованы оксидом кремния(IV) SiO2. К ним относятся горный хрусталь, кварц, кремнезем. Оксид кремния(IV) составляет основу таких полудрагоценных камней, как агат, аметист, яшма (цв. вклейка, рис. 28). Рис.28. Кристаллы кварца (а) и поперечный разрез агата (б) Диоксид кремния - твердое кристаллическое вещество полимерного строения, в котором каждый атом кремния связан с четырьмя атомами кислорода прочными связями: Это типичный кислотный оксид, который в воде не растворяется. Его гидроксиды - кремниевые кислоты - получают косвенными методами. Диоксид SiO2 взаимодействует со щелочами, образуя силикаты: SiO2 + 2КОН = К2 SiO 3 + Н2O Диоксид кремния сплавляют образованием силикатов: с основными оксидами также с SiO 2 + СаО = Са SiO3 С кислотами (за исключением плавиковой кислоты) диоксид кремния не взаимодействует. Монокристаллы диоксида кремния применяют в генераторах ультразвука, звуковоспроизводящей аппаратуре и т.п. Такие кристаллы выращивают в гидротермальных условиях из расплавов SiO 2. Природный SiO 2 - сырье в производстве кремния, кварцевого стекла, компонент керамики, обычного стекла и цемента. Из расплавленного кварца изготавливают различную кварцевую химическую посуду, которая выдерживает высокую температуру и не трескается при резком охлаждении. Вопросы 1. Какие типы оксидов образуют неметаллы? Какое агрегатное состояние для них характерно? 2. Какие типы кристаллических решеток характерны для твердых оксидов неметаллов? Какие из оксидов имеют полимерное строение? 3. Напишите формулы оксидов серы, а также уравнения реакций, характеризующие их свойства. 4. Напишите формулы оксидов азота, а также уравнения реакций, характеризующие их свойства. 5. Напишите формулы оксидов углерода, а также уравнения реакций, характеризующие их свойства. 6. Напишите уравнения реакций, с помощью которых можно осуществить следующие превращения: а) FеS2 ⟶ SO, ⟶ Na2SO3 ⟶ SO2 ⟶ SO3 ⟶ Н2SO4 ⟶ Na2SO4 ⟶ ВаSO4 б) N2 ⟶ NH3 ⟶ NO ⟶ NO2 ⟶ НNО3 ⟶ Сu(NO3)3 ⟶ NO2 в) СаСO3 ⟶ СО2 ⟶ СаСO3 ⟶ Са(НСO3)2 ⟶ СаСО3 ⟶ СO2 г) SiO2 ⟶ Si ⟶ Мg2Si ⟶ SiH4 ⟶ SiO2 ⟶ Мg2SiO3 Рассмотрите процессы в свете теории электролитической диссоциации и окисления- восстановления. 7. Сравните строение и свойства оксидов углерода(IV) и кремния(IV).
В оксидах неметаллов связь между атомами ковалентная полярная. Среди оксидов молекулярного строения есть газообразные СO 2 , SO 2 , N 2 O, СО, NO и др., жидкие (летучие) SO 3 , N 2 O 3 , твердые (летучие) Р 2 O 5 , N 2 O 5 , SeO 2 . Твердый, очень тугоплавкий оксид SiO 2 - вещество с атомной кристаллической решеткой.
Оксиды неметаллов делят на две группы: несолеобразующие и солеобразующие. К несолеобразующим оксидам относятся SiO, N 2 O, NO, NO 2 , CO. Все остальные оксиды неметаллов являются солеобразующими, кислотными. При растворении их в воде образуются гидраты оксидов - гидроксиды, по своему характеру являющиеся кислотами. Кислоты и кислотные оксиды в результате химических реакций образуют соли, в которых неметалл сохраняет степень окисления.
Например:
Кислотный оксид SiO 2 нерастворим в воде, но ему также соответствует гидрат в виде кислоты H 2 SiO 3 и соли:

Оксиды и соответствующие им гидроксиды - кислоты, в которых неметалл проявляет степень окисления, равную номеру группы, т. е. высшее ее значение, называют высшими. Рассматривая Периодический закон, мы уже характеризовали их состав и свойства, например:

В пределах одной главной подгруппы, например VI группы, действует следующая закономерность изменения свойств высших оксидов и гидроксидов.
Если неметалл образует два или более кислотных оксидов, а значит, и соответствующих кислородсодержащих кислот, то их кислотные свойства усиливаются с увеличением степени окисления неметалла.

-
!!! Оксиды такого состава неизвестны; НСlO 2 даже в водном растворе быстро разлагается.
Оксиды и кислоты, в которых неметалл имеет высшую степень окисления, могут проявлять только окислительные свойства.

Особенности сильнейших окислителей азотной кислоты HNO 3 и концентрированной серной кислоты H 2 SO 4 проявляются в реакциях с металлами, неметаллами, органическими веществами. Эти их свойства мы рассмотрим в § 20.
Оксиды и кислоты, где неметалл имеет промежуточную степень окисления, могут проявлять и окислительные, и восстановительные свойства.

13. Основные классы неорганических соединений. Оксиды металлов и неметаллов. Номенклатура этих соединений. Химические свойства основных, кислотных и амфотерных оксидов.
Оксиды – соединения элемента с кислородом.
Оксиды не образующие кислот, оснований и солей при обычных условиях, называются не солеобразующими.
Солеобразующие оксиды подразделяются на кислотные, основные и амфотерные (обладающие двойственными свойствами) . Неметаллы образуют только кислотные оксиды, металлы – все остальные и некоторые кислотные.
Основные оксиды - это сложные химические вещества, относящиеся к окислам, которые образуют соли при химической реакции с кислотами или кислотными оксидами и не реагируют с основаниями или основными оксидами.
Свойства:
1. Взаимодействие с водой:
Взаимодействие с водой с образованием основания (или щёлочи)
CaO+H2O = Ca(OH)2 (известная реакция гашения извести, при этом выделяется большое количества тепла!)
2. Взаимодействие с кислотами:
Взаимодействие с кислотой с образованием соли и воды (раствор соли в воде)
CaO+H2SO4 = CaSO4+ H2O (Кристаллы этого вещества CaSO4 известны всем под названием "гипс").
3. Взаимодействие с кислотными оксидами: образование соли
CaO+CO2=CaCO3 (Это вещество известно всем - обычный мел!)
Кислотные оксиды - это сложные химические вещества, относящиеся к окислам, которые образуют соли при химическом взаимодействии с основаниями или основными оксидами и не взаимодействуют с кислотными оксидами.
Свойства:
Химическая реакция с водой CO 2 +H 2 O=H 2 CO 3 - это вещество - угольная кислота - одна из слабых кислот, её добавляют в газированную воду для "пузырьков" газа.
Реакция с щелочами (основаниями): CO 2 +2NaOH=Na 2 CO 3 +H 2 O- кальцинированная сода или стиральная сода.
Реакция с основными оксидами: CO 2 +MgO=MgCO 3 - получившая соль - карбонат магния - ещё называется "горькая соль".
Амфотерные оксиды - это сложные химические вещества, также относящиеся к окислам, которые образуют соли при химическом взаимодействии и с кислотами (или кислотными оксидами) и основаниями (или основными оксидами). Наиболее частое применение слово "амфотерный" в нашем случае относится к оксидам металлов.
Свойства:
Химические свойства амфотерных оксидов уникальны тем, что они могут вступать в химические реакции, соответствующие как основаниями так и с кислотами. Например:
Реакция с кислотным оксидом:
ZnO+H2CO3 = ZnCO3 + H2O - Образовавшееся вещество - раствор соли "карбоната цинка" в воде.
Реакция с основаниями:
ZnO+2NaOH=Na2ZnO2+H2O - полученное вещество - двойная соль натрия и цинка.
14. Основания.Номенклатура оснований. Химические свойства оснований. Амфотерные основания, реакции их взаимодействия с кислотами и щелочами.
Основаниями называются вещества, в которых атомы металла связаны с гидрокси-группами.
Если вещество содержит гидрокси-группы (ОН), которые могут отщепляться (подобно отдельному "атому") в реакциях с другими веществами, то такое вещество является основанием.
Свойства:
Взаимодействие с неметаллами:
при нормальных условиях гидроксиды не взаимодействуют с большинством неметаллов, исключение - взаимодействие щелочей с хлором
Взаимодействие с кислотными оксидами с образованием солей: 2NaOH + SO 2 = Na 2 SO 3 + H 2 O
Взаимодействие с кислотами -реакция нейтрализации:
с образованием средних солей: 3NaOH + H3PO4 = Na3PO4 + 3H2O
условие образования средней соли - избыток щелочи;
с образованием кислых солей: NaOH + H3PO4 = NaH2PO4 + H2O
условие образования кислой соли - избыток кислоты;
с образованием основных солей: Cu(OH)2 + HCl = Cu(OH)Cl + H2O
условие образования основной соли - избыток основания.
С солями основания реагируют при выпадении осадка в результате реакции, выделения газа или образования малодиссоциирующего вещества.
Амфотерными называются гидроксиды, которые проявляют и основные и кислотные свойства в зависимости от условий, т.е. растворяются в кислотах и щелочах.
Ко всем свойствам оснований добавляются взаимодействие с основаниями:
Al(OH)3 + NaOH = Na
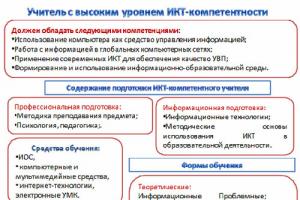
Разработала урок учитель химии Ильясова Лилия Сахиповна муниципального бюджетного образовательного учреждения «Средняя общеобразовательная школа №6» города Альметьевска Республики Татарстан.
Тема урока: «Оксиды металлов и неметаллов - состав и названия»
Тип урока: Урок формирования первоначальных предметных навыков, овладения предметными умениями.
Цели урока: Организовать деятельность учащихся по формированию знаний по теме оксиды, научить самостоятельно, выдвигать признак классификации.
Задачи:
Образовательные: усвоение новых знаний на основе имеющихся, самостоятельный поиск новых знаний из различных источников и закрепление практических умений и навыков;
Развивающие: развитие познавательного интереса, самостоятельности мышления, памяти, инициативы учащихся через использование коммуникативно-деятельностной методики, частично-поискового подхода и элементов проблемного обучения;
Воспитательные: формирование коммуникативных умений, культуры общения, сотрудничества.
Структура урока:
1.Организационный этап – 2 мин.
2.Подготовительный этап (мотивация и актуализация) – 7 мин.
3.Основной этап:
усвоения новых знаний и способов деятельности;
первичной проверки понимания изученного;
закрепления новых знаний и способов деятельности – 25 мин.
4.Информация о домашнем задании – 5 мин.
5.Подведение итогов учебного занятия. Рефлексия – 6 мин.
Этапы учебного занятия
Образовательные задачи этапа
Деятельность учителя
Деятельность учащихся
Показатели выполнения образовательных задач этапа
1. Организационный
Подготовка учащихся к работе на уроке
Организует процесс подготовки к занятию
Организационный настрой на работу
Доброжелательный настрой преподавателя и учащихся; быстрое включение учащихся в деловой ритм
2. Подготовительный
1.Обеспечение мотивации учения учащихся, принятие ими целей урока.
2.Актуализация субъектного опыта учащихся
1.Создание проблемной ситуации с целью определения темы занятия.
2.Предлагает работу по учебному тексту с целью определения задач учебного занятия и актуализации субъектного опыта учащихся
1.Решают проблемную ситуацию, предлагают варианты темы учебного занятия
2.Работают по учебному тексту, обсуждают результаты работы в паре, формулируют адаптивную цель учебного занятия
Готовность учащихся к активной учебно- познавательной деятельности, понимание учащимися ценности изучаемого материала
3. Усвоения новых знаний и способов деятельности
Первичной проверки понимания изученного
Закрепления новых знаний и способов деятельности
1.Обеспечение восприятия и первичного запоминания информации
2.Установление правильности и осознанности усвоения новых знаний, выявление пробелов и их коррекция
3.Обеспечение усвоения способов действий на уровне применения в знакомой и изменённой ситуации
1.Выстраивает систему последовательных блоков информации
2.Предлагает учащимся фронтальные задания с целью первичной проверки понимания
3.Предлагает учащимся индивидуальные задания с целью закрепления новых знаний и способов деятельности
4.Предлагает учащимся тест для первичной проверки понимания изученного
1.Воспринимают учебную информацию, определяют отличительные признаки изучаемого объекта
2.Выполняют предлагаемые учителем задания для фронтальной и самостоятельной работы
3.Выполняют тест
1.Учащиеся активно работают при изучении нового материала
2.Правильность и осознанность ответов в процессе выполнения заданий
4. Информации о домашнем задании
Обеспечение понимания учащимися цели, содержания и способов выполнения домашнего задания
Дает информацию о домашнем задании
Записывают информацию о домашнем задании
Учащиеся осознали цель, содержание и способы выполнения домашнего задания
5. Подведения итогов учебного занятия
Рефлексии
Обеспечение анализа успешности достижения цели и постановки перспективы следующей работы,
осознания процесса и результата своей учебной деятельности
Предлагает учащимся вернуться к учебному тексту и определить уровень достижения цели, проанализировав результат своей работы
Учащиеся работают по учебному тексту, определяют уровень достижения цели, обсуждают результаты работы в паре, формулируют перспективную цель следующего учебного занятия
Цели занятия реализованы, учащиеся получили информацию об индивидуальных результатах учения
Ход урока:
1. Организационный этап
Учитель приветствует учащихся. Учащиеся проверяют наличие необходимого инструментария для урока.
2. Подготовительный этап
Учитель : На предыдущем уроке мы с вами изучали « Простые вещества – металлы и неметаллы». Для того чтобы проверить на сколько вы усвоили урок мы проделаем следующее задание. Сначала дайте определение простое вещество.
Ученик: Простые вещества - это вещества, образованные из разновидности атомов одного химического элемента.
Учитель : Задание: У вас на столах лежат формулы веществ, каждый ученик возьмет одну формулу из предложенных и скажет почему выбрал именно ее.
1 стол: О 2, Ca, AL, S, N 2, СО 2, CO
2 стол: О 2, Ca, AL, S, N 2, SO 2, SiO 2
3 стол : О 2, Ca, AL, S, N 2, Fe 2 O 3 , FeO,
4 стол : О 2, Ca, AL, S, CaO, Н 2 SO 4 , N Н 3
Учащиеся рассказывают и обосновывают свой выбор.
Посмотрите на формулы, которые у вас остались. Как вы думаете, что здесь лишнее.
Ученик: NН 3 и Н 2 SO 4
Учитель : Как вы определили.
Ученик: И у всех оставшихся формул в состав молекулы входит кислород. В состав последней формулы входят три разных атома химических элементов, а остальные состоят из двух элементов один из которых кислород.
Учитель : С этими веществами мы уже сталкивались на предыдущих уроках. Так, о чём же мы будем сегодня говорить? Какова тема нашего разговора?
Ученик: Об оксидах.
Учитель : Вы правильно определили тему нашего разговора.
Я хочу её немного конкретизировать и напишу на доске, вы работаете со мной в тетрадях.
«Оксиды металлов и неметаллов - состав и названия» §14 стр. 71
А как вы думаете, в чем заключается цель нашего урока.
Ученик: Изучить оксиды металлов и неметаллов их состав и названия.
3. Усвоения новых знаний и способов деятельности.
Перепишите формулы с доски.
Как вы считаете, что же общего между ними?
(Дети говорят о схожести состава молекул.)
Верно. Они состоят из двух элементов. И так, что такое оксиды?
Ученик: Оксиды это сложные вещества, в состав которых входят атомы двух химических элементов, один из которых - кислород.
Названия оксидов
Учитель: Посмотрите на формулы оксидов, которые записаны у вас в тетради.
на стр.72 учебника в таблице даны химические названия этих оксидов и исторически сложившиеся.
Дайте названия СО 2, CO , SO 2, SiO 2 Fe 2 O 3 , FeO , CaO.
Почему в некоторых формулах мы не указали валентность, а в некоторых указали?
(учащиеся выдвигают версию о том, что для элементов с постоянной валентностью не надо указывать, для элементов с переменной валентность необходимо указать валентность.)
По международной номенклатуре названия оксидов происходят от названия химических элементов с добавлением слова “Оксид”(оксиген). Если элемент имеет переменную валентность, то она указывается римскими цифрами, взятыми в скобки после названия химического элемента.
Поскольку оксиды могут быть образованы почти всеми химическими элементами (за некоторым исключением), необходимо, чтобы не было путаницы, чтобы у каждого было свое название. Давайте вместе разработаем основные правила современной международной номенклатуры (учащиеся сами подходят к решению проблемы)
Название оксида = "Оксид" + Название элемента в родительном падеже + валентность римскими цифрами
Задание №4
Сравните состав оставшихся формул и разделите их на группы. Ответ
(учащиеся говорят, что в первых двух формулах на первом месте стоит неметалл, а в третьей формуле – металл.)
Оксиды неметаллов называют кислотными оксидами.
Оксиды металлов называют основными оксидами.
Существуют амфотерные элементы они образуют амфотерные оксиды.
Амфотерность – способность элементов и веществ проявлять двойственные свойства.
Амфотерными являются Be, Zn, Al и некоторые другие элементы.
Но при классификации оксидов нужно учесть, что один и тоже элемент может образовать разные оксиды например: оксид хрома(II ) – CrO -основный; оксид хрома( VI ) CrO 3 - кислотный; оксид хрома(III ) Cr 2 O 3 амфотерный.
Как вы думаете, по какому признаку оксиды отнесли к разным группам.
(учащиеся говорят, что разная валентность) Да, действительно элементы, которые являются металлами и имеют валентность I - II образуют основные; элементы проявляющие валентность III амфотерные; элементы имеющие валентность IV -V II - кислотные оксиды
На столах оксиды (Al 2 O 3 , SO 3 , МgO, K 2 O) посовещайтесь, разделите их на группы и поднимите формулы основного, кислотного, амфотерного оксидов.
Физические свойства оксидов.
Что такое физические свойства?
Рассмотрите образца оксидов (вода, оксид хрома, оксиды железа, оксид кальция, оксид алюминия и др.)
Демонстрация: Открываем бутылку газированной воды. Наблюдаем
Сделайте выводы о физических свойствах оксидов.
(учащиеся самостоятельно записывают основные физические свойства оксидов, оксиды бывают твёрдые, жидкие и газообразные, различного цвета. Например, оксид меди (II) CuO чёрного цвета, оксид кальция СаО белого цвета – твёрдые вещества. Оксид водорода- бесцветная летучая жидкость, а оксид углерода (IV) СО 2 - бесцветный газ при обычных условиях.”
Информация о распространении оксидов в природе и их значении.
Вы получили задания в группах подготовить сообщения о некоторых оксидах.
1 группа СО 2, CO
1. Угарный газ (СО) попадает в воздух при сжигании топлива в печах и двигателях автомобилей. Ядовит, т.к. соединяется с гемоглобином крови, в результате чего кровь не способна переносить кислород из легким к тканям. Это вызывает удушье. При 10-минутном вдыхании наступает летальный исход.
2.Углекислый газ (СО2) – кислотный оксид, входит в состав воздуха. Не ядовит. Малозаметная “ вуаль ”, состоящая из СО 2 , воды, озона и метана является в атмосфере своеобразным фильтром, пропуская 70% солнечного излучения, она задерживает отражаемые Землёй тепловые лучи. Вследствие этого у поверхности нашей планеты, словно под стеклянной крышей оранжереи, температура поддерживается более или менее на одном уровне от -40 до + 40°С. Однако все возрастающие количество сжигаемого топлива приводит к тому, что содержание углекислого газа в атмосфере неуклонно увеличивается. Изменение климата планеты вследствие концентрации парниковых газов в атмосфере является на сегодняшний день одной из основных глобальных экологических проблем. Примерно 80% парникового эффекта приходится на углекислый газ. Если не остановить это губительное для человечества увеличение содержания СО 2 в атмосфере, то под море уйдут Гамбург и Гонконг, Лондон и Копенгаген. Европа станет засушливой зоной с массой вредных насекомых и болезнетворных микроорганизмов.
Учитель: Да. Проблема загрязнения природной среды становится столь острой как из-за роста объемов промышленного и сельскохозяйственного производства, так и в связи с качественным изменением производства под влиянием научно-технического прогресса. Но есть пути решения этих проблем. Назовите их
Учащиеся:
1) установка очистных сооружений 2) озеленение территорий 3) возникновение и деятельность разного рода “зеленых” движений и организаций: Green Peace ,Фонд дикой природы, департамент экологии.
2.группа
Богата природа кварцевыми песками и глиной, в состав которых входят такие оксиды как оксид (IV) SiO 2 и алюминий оксид.
Гай Плиний Секунд древнеримский писатель-эрудит, считал, что горный хрусталь “рождается из небесной влаги и чистейшего снега”. Однако состав его иной: оксид кремния (IV) SiO 2 .
Кварц, кремень, горный хрусталь, аметист, яшма, опал - все это оксид кремния, Окрашенный различными примесями образует драгоценные и полудрагоценные камни – яшма, аметист, агат.
Более 50 % земной коры состоит из SiO 2
2) Al 2 O 3 * 2SiO 2 * 2 H 2 O – белая глина, в основном состоит из оксидов алюминия и кремния.
3.группа
3) Руды железа – красный (Fe 2 O 3), бурый (Fe 2 O 3 * n H 2 O) и магнитный железняки
(Fe 3 O 4 или FeO * Fe 2 O 3)
Велико значение железа в жизни человека и его роль в истории цивилизации. Одним из самых распространенных металлов в земной коре является железо. Применять его начали гораздо позже других металлов (меди, золота, цинка, свинца, олова), что, скорее всего, объясняется малым сходством руды железа с металлом. Первобытным людям было очень трудно догадаться, что из руды можно получить металл, который успешно можно использовать при изготовлении различных предметов, сказалось отсутствие инструментов и необходимых приспособлений для организации такого процесса. До того времени, когда человек научился получать из руды железо и изготавливать из него сталь и чугун, прошло довольно длительное время. На данный момент железные руды являются необходимым сырьем для черной металлургии, теми полезными ископаемыми, обходиться без которых не сможет ни одна развитая промышленная страна. Издавна люди верили в то, что намагниченный гематит способен улучшить не только физическое состояние тела, но и восстановить душевный баланс. Камень гематит усиливает энергетику своего владельца, помогает достичь желаемого.
Получение оксидов:
Мы уже встречались с оксидами, при изучении темы “ Простые вещества – металлы и неметаллы”. При взаимодействии разных веществ с кислородом получают оксиды.
Вспомните, из каких веществ можно получить оксиды.
(учащиеся вспоминают, что оксиды получают при взаимодействии кислорода с простыми веществами.)
Работа учащихся.
Записать уравнения реакций взаимодействия металлов с кислородом и неметаллов с кислородом, назвать продукты (работа у доски)
Допишите уравнения 1)Si + O 2 =
2) Al +O 2 =
Какие еще вещества, кроме простых веществ вам известны?
(ответ учащихся – сложные вещества)
Дайте определения сложным веществам
(учащиеся формулируют определение сложных веществ)
Как горят сложные вещества?
(ответ учащихся – с образованием двух продуктов, а именно двух оксидов)
2. Взаимодействие сложных веществ с кислородом
Работа учащихся.
Записать уравнение реакции взаимодействия метана с кислородом, назвать продукты (работа у доски) CH 4 + O 2 =
А сейчас я познакомлю вас с новыми, неизвестными еще для вас способами получения оксидов.
3. Разложение оснований
Mg(OH) 2 = MgO + H 2 O
4. Разложение кислот
H 2 CO 3 = H 2 O + CO 2
4. Закрепление изученного материала
Проверим свои знания – тест делает стол 1,2, 4
А стол № 4 упражнение “не прерви цепочку”(Для каждого ученика приготовлена карточка с формулой оксида. Ученик поднимает карточку, показывает всем, и дает название оксиду. Работа по цепочке. N 2 O 3 ? SrO ?ZnO?SnO 2 ? Aq 2 O ? Cl 2 O 7 )
Тест вариант 1
1. При нормальных условиях оксиды - это вещества:
а) только газообразные
б) только жидкие
в) газообразные, жидкие и твердые
г) только твердые
2. Оксиды – это:
н) вещества, в состав которых входит 3 элемента один из которых кислород.
о) вещества, в состав которых входит 2 элемента один из которых кислород.
п) вещества, в состав которых входят металлы
3. Как называется оксид SO 2 ?
в) оксид серы
г) оксид серы (II)
д)
оксид серы (IV)
е) оксид серы (VI)
4. Какие вещества получим при разложении CaCO 3 ?
а) СаО и СО 2
б) Са и О 2
в) Са и СО 2
г) С и СаО
Тест вариант 2
1. Формула амфотерного оксида, это
о)Cr 2 O 3 м) N 2 O 5 г) BаO д) As 2 O 3
2. Только основные оксиды расположены в ряду
б). H20, CaO, S0 2 е). Li20, NaOH, NO
ж) N 2 О 5 , S О 2 , SO 3 к) . Ba0, Li 2 O, Cr0
3. Как называется оксид SO3?
в) оксид серы
г) оксид серы (II)
д) оксид серы (IV)
с) оксид серы (VI)
4. Из приведенных формул веществ оксидом является
о)NaCl, и)Na 2 O е) НСl
5. Какие вещества образуются при разложении AL(OH)3
а) AL и О 2 д) Al 2 O 3 и H 2 O в) О 2 и H 2 O
Ответ теста: Вода это оксид
А о нем мы поговорим на следующем уроке.
Домашнее задание.
6. Подведение итогов урока.
Что узнали нового?
Что было наиболее интересным?
О чем хотелось бы узнать больше?
Выставление оценок за урок.